支气管成形术和肺动脉成形术
引言
支气管成形术和肺动脉 (pulmonary artery,PA) 重建技术开始是为了避免心肺功能受损的患者进行全肺切除术 (pneumonectomy,PN),随着手术技术和围手术期管理经验的不断增加,近年来得到了广泛应用。最新发表的数据表明,这些手术虽然相对于标准肺切除术而言具有挑战性,但由经验丰富的胸外科医师进行手术,可以提供更好的整体效果[1-4]。
良好的临床和肿瘤学结果使保留肺的重建手术逐渐成为治疗大多数中央型肺肿瘤的首选,即使是对于肺功能储备良好的患者。这一策略反过来又鼓励了新技术的发展,这些技术进一步提高了支气管血管重建的可靠性,扩大了手术适应证,从而减少了PN [5]。大部分人都将 PN 的状态视为一种疾病,PN会严重损害心肺功能,并最终降低患者的术后生活质量,从这一方面来说保留更多肺功能的支气管血管重建手术具有更大的意义。因此,近年来在这个问题上达成的普遍共识,只有在获得无瘤切缘必不可少时才考虑全肺切除[6,7],毕竟肿瘤学的目标仍然是完整的肿瘤切除。
本文参考大量已发表的关于这些经验所报告的相关结果,重点介绍支气管和肺动脉重建手术的主要技术。
术前评估
在术前确定重建手术的正确适应证并不那么容易;然而,在计划进行可能的支气管或血管重建手术时,细致和完整的术前分期更为重要。
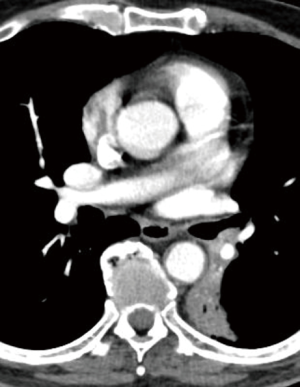
在大多数情况下,使用静脉对比剂的计算机断层扫描(Computed tomography,CT) 是首选诊断工具。如果怀疑支气管侵犯,则必须通过术前纤维支气管镜检查评估支气管是否侵犯以及侵犯的程度;这种检查最好由一位手术的外科医生进行。在诱导治疗后,如果可行,应将支气管的内镜状态与治疗前的状态进行比较。然而,在少数患者中,术中探查可能显示肿瘤侵犯局限于支气管壁的外表面,在支气管镜中未见侵犯;在这种情况下,支气管壁僵硬可能是支气管周围侵犯的内镜间接征象。近年来,支气管内超声检查进一步提高了纤维支气管镜检查的准确性。然而,仅根据术前影像学评估来确定PA成形术的正确适应证可能会很复杂。 新辅助治疗后PA浸润程度和范围更加难以界定且存在争议。在术前再分期 CT 中,通常很难区分是放化疗相关的弥漫性结缔组织增生反应和纤维化,还是肿瘤残留。主动脉造影和磁共振血管造影 (MRA) 可以提供有用的附加信息来评估血管侵犯的模式;然而,术前放射学证据可能高估或低估血管受累,并导致错误的适应证 [8]。因此,是替代标准肺叶切除的重建手术还是PN ,通常由外科医生根据术中发现做出最终决定。
适应证及手术技术
在中央型肺肿瘤患者中,支气管成形术、肺动脉重建或两者的传统适应证是肿瘤延伸到叶支气管的开口和(或)超过肺动脉叶支的根部,但没有累及残留叶需要到PN的程度。如果支气管和(或)PA 被转移性 N1 淋巴结侵犯,也可能需要进行袖状切除术,这通常是左肺上叶恶性肿瘤患者的情况,需要联合支气管血管重建。此外,新辅助化疗后出现的不可分离的肺门瘢痕组织是重建手术的额外适应证。
由于纤维化或炎症组织反应的存在可能会对手术切除肿瘤的完整性产生怀疑,因此必须通过冰冻切片分析对切缘进行术中病理学评估,以便选择最合适的切除方式。需要技术专长和成熟的手术判断,因为通常术中可判断肿瘤适合袖状切除或PN,或认为不可切除。
通过开胸手术可以很容易完成。后外侧或外侧保留肌肉的切口对肺门和肺裂暴露良好,从而允许准确解剖支气管和近端血管。尽管如此,一些作者报道了VATS 袖状切除术成功的报告 [9,10]。
大多数重建手术是针对起源于上叶的肿瘤进行的,而下叶和(或)中叶肿瘤的患者很少需要进行支气管血管重建。
上叶支气管袖状切除术
在右侧,气管的解剖从上叶支气管 (ULB) 的前上方开始。接下来将肺向前牵拉,并暴露 ULB 和中间支气管之间的分叉。裂内动脉是通过解剖中叶肺门后面的斜裂,从前到后进行的。在这个阶段,必须确保中叶和下叶的动脉分支是正常的;否则,应考虑更多的肺组织切除(甚至 PN)。一旦发现下叶背段的动脉分支,就可以用线性缝合器离断斜裂后部。在ULB和中间支气管之间的空间内,通过从后面继续解剖PA可以很容易地确定背段动脉;通过这种方式,可以避免在肺裂水平进行广泛的实质解剖,从而减少漏气的发生率。于中间支气管远端悬吊,以协助进行气道离断。一旦确认可以切除,闭合离断上叶肺动脉分支。同样,闭合离断上叶的肺静脉 (PV) 分支,并注意保留中叶静脉。剩余斜裂通过线性缝合器离断。接下来,通过悬吊控制主支气管。首先于ULB 起点的上方横切主支气管,然后于右上支气管下方横切中间支气管,切割线必须垂直于气管的长轴。
在左侧应注意防止损伤左侧 PA 的尖后段分支。沿着动脉继续解剖,直到识别下叶的背段分支,使用直线缝合器闭合离断斜裂后部。接下来,将上叶的动脉分支结扎并分开。上叶 PV 也闭合离断,从而暴露 ULB。斜裂的前部用直线缝合器闭合离断。悬吊主支气管,在支气管分叉处近端首先横切主支气管。接下来,横切左下叶支气管;在此过程中,切割气管时必须小心,以保证下叶背段支气管的完整性,该支气管可能非常接近切割线。
只有在气管分开并得到肉眼和显微镜结果的支持后,才能最终选择进行袖状肺叶切除术 (SL)。如果在冰冻切片分析中发现肿瘤侵犯支气管切缘,则可能需要额外切除相关残端甚至进行PN。
一旦达到完全切除肿瘤的目的并在显微镜下确认切缘正常,吻合时间便开始。多年来,已经提出了不同的重建技术。尽管其他研究人员已报道使用连续缝合(完全或部分)[7,11],但目前作者倾向于采用4/0单丝可吸收材料“从外到内”的间断缝合方式[12]。在我们的技术中,前几针从纵隔侧的软骨部和膜部支气管之间开始缝合,沿着膜部继续缝合;这些缝合线可以立即打结,以防止支气管扭转,并最终提高吻合的稳定性,继续转向支气管外侧以完成软骨部第一部分的缝合。一旦到达软骨部的中点,以类似的方式在另一侧完成吻合。从支气管软骨部两端开始,一根一根地缝合,并向中间缝合,从而轻轻地扩张远端气道的周长。这些技术措施甚至可以补偿两个支气管末端之间的大口径差异。
少见的支气管袖状切除
左下或右中下肺叶切除术(所谓的“Y”袖切除术)后 ULB 的重建并不常见。右侧袖状双叶切除术适用于支气管中间段支气管向上延伸的腔内病变,靠近上叶支气管开口,不宜进行标准的双叶切除术。右主支气管在右上叶支气管起始端附近分开;右 ULB 在其近端切开,然后与主支气管吻合。进行吻合时,必须特别注意避免由于中叶和下叶切除后 ULB 的重新定向而导致支气管扭转。关于主支气管和上叶支气管之间明显的尺寸差异,这可以通过仔细和精确地放置缝合线来成功克服,如上一段所述。
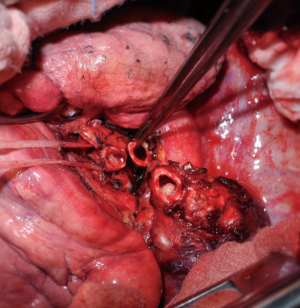
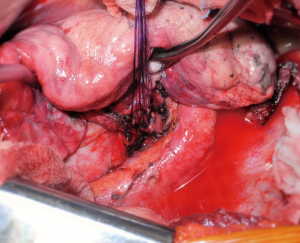
在左侧,当肿瘤侵犯下叶支气管起始部时必须考虑“Y”袖切除,但必须保证上叶支气管开口没有侵犯(图1)。游离支气管后,悬吊左主支气管和左ULB。接下来,在靠近叶支气管分叉处横切主支气管。分割左侧 ULB 时必须小心,确保可能出现在切线边缘的舌支气管完整性(图2)。最后, 根据上面的描述完成吻合 (图3)。然而,如果左主干和 ULB 之间的口径差异不大,可以考虑部分连续缝合,特别是在暴露不良的支气管纵隔侧[13]。
中叶袖状切除术很少进行,首先离断中叶静脉可以为中叶支气管提供良好的暴露。 中间支气管由直角钳悬吊,在中叶支气管起点上方离断; 然后在中叶支气管下方离断。 支气管末端的近端和远端横断线必须略微倾斜,以便保护右下叶背段支气管开口。离断支气管时,必须小心避免 PA 损伤,因为它位于气管的正后方并略高于该气管;最后,闭合离断中叶的动脉分支。支气管吻合是根据先前描述的技术进行的。
气管围手术期管理
吻合结束后,无菌溶液填充胸膜腔,肺通气检查支气管缝线是否漏气,针孔漏气一般可以忽略。小漏气需要通过间断缝合加强,大的漏气需要重新吻合。
为了最大限度地减少支气管重建后裂开的风险,必须减少吻合口处的张力。这可以通过分离下肺韧带来减轻吻合口张力,或者在右侧更常见的是通过打开 PV 周围的心包来实现。
大多数作者推荐用活组织瓣保护支气管吻合口 [14,15],其对行双支气管成形术和 PA 重建的情况更合适。目前通常采用肋间肌瓣,通过其肋间动脉提供良好的血管化,即使在小的吻合口裂开的情况下也能保持气密性,并限制 PA 侵蚀的风险,尤其是在进行相关血管重建时。肋间肌瓣获取和转位技术已有大量报道[12,14]。因为需要在开胸前准备肋间肌,所以只要有可能进行支气管血管手术,就应该提前准备肋间肌瓣。在没有可用的肋间肌瓣的情况下,纵隔脂肪垫、壁层胸膜或心包也可以替代[15]。
术后立即常规给予全身低剂量类固醇激素,以减轻水肿,从而减少分泌物潴留和肺不张,促进肺复张,减少重建处黏膜肉芽形成并且没有增加吻合口裂开的风险。雾化吸入类固醇激素也是术后治疗的一部分。
在手术结束后和出院前应通过纤支镜检查吻合口,然后定期随访行纤维支气管镜检查。
PA重建
肺动脉的左、右主干可能直接受累于肺门肿瘤,或通过与转移淋巴结的不同程度的接触而受累。此外,纤维化瘢痕组织的持续存在,尤其是在诱导治疗后,也可能需要血管重建手术。
当肿瘤侵犯局限于动脉壁的一面,例如存在侵犯PA的一个叶支时,简单的切线切除加直接修复(连续缝合或机械吻合器)通常足以实现完全切除。因为这种技术只是标准血管结扎的一种变化,本文不再进一步探讨。去除浸润多达 30% 的 PA 壁周长的病变,导致的较大血管缺损时,可以采用生物或合成材料修补,从而避免动脉袖状切除术。更广泛的血管受累需要横断动脉,随后通过端到端吻合或通过插入人工导管进行重建。然而侵犯更广的PA情况,例如在左上叶肿瘤从 PA 的凹面浸润到前基底动脉的情况下,或者在右侧,从肺动脉上叶分支向后外侧侵犯到下叶背段的动脉分支,需要 PN 才能完全切除肿瘤。
手术的第一步是确保对近端 PA 的控制,然而,闭合离断上肺静脉应推迟到手术确定可行后进行,因为通常情况下,该血管的离断可促进PA的暴露。在近端肺动脉钳夹后,可以更安全地解剖叶间裂。在左侧,我们更喜欢从背面开始,在主 PA 的水平上通过血管膜下平面向前和向下游离。在右侧,我们通过在中叶后面从前到后解剖来接近 PA,确定下叶背段的分支。为了避免经肺裂进行过大的解剖肺实质,可以在ULB和中间支气管之间的分叉处继续暴露该血管。一旦PA的主要分支和远端分支、PVs和支气管做好准备,切除时间就开始了。随着时间的推移,随着技术经验的增长和平均钳夹时间的减少,抗凝剂的给药量逐渐减少到大约 25 单位/公斤,而不是过去使用的 3,000 和 5,000 单位之间的剂量 [16]。如今,我们通常在夹住近端 PA 之前给予 1,500 至 2,000 IU 肝素钠。该剂量已被证明可有效减少术后渗出,尤其是淋巴结清扫部位的渗出,而不会增加血栓事件的发生率。为了控制回流,我们现在更倾向于将动脉血管夹在离浸润部位较远的下游,而不是过去我们用来夹住PV。一旦血管重建完成,解除钳夹后肝素不会被硫酸鱼精蛋白逆转。
PA的部分切除
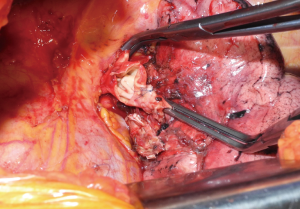
选择补片成形术的传统适应证是 PA 浸润限制在血管壁整个圆周的一半以下(图4); 这种情况包括多种情况,从局限侵犯肺段动脉到侵袭性恶性肿瘤的纵向切除导致的较大缺损。在某些情况下,PA的一个侧面存在纵向延伸缺陷(长度超过2.5 cm),当血管圆周的另一侧没有肿瘤时,可以考虑通过宽补片重建[17]。如果浸润范围更广,则需要血管袖状切除,随后进行端端吻合或需要插入导管。
多年来,各种不同的材料用于肺动脉补片,包括合成和生物材料(自体和异种)。在生物替代品中,心包组织被广泛使用,是作者的首选。后者具有一系列优势,例如适当的厚度和机械强度,胸部两侧均可采用,甚至允许修复较大的缺陷,以及与异源材料相比的良好生物相容性;最重要的是,它也是免费的。然而,新鲜的自体心包也有一些技术上的缺陷,因为它有收缩和卷曲的倾向,这使得贴片更难剪裁和缝合到血管壁上。相比之下,牛心包的柔韧性较低,其边缘更加一致和僵硬,有利于重建过程。为了改善自体心包的技术特性,作者开发了一种术中方法,通过戊二醛缓冲溶液稳定自体心包组织;这种固定技术已在我们之前已报道过 [18]。通过这个技巧,可以最大限度地减少新鲜心包补片回缩和卷曲的情况,从而使血管重建更容易,并降低与边缘回缩相关的缝线术后出血的风险。如果选择自体移植,则在同一手术中,通过将心包向前切割至膈神经,留下心包缺损,可以获得理想的组织。静脉补片(奇静脉、隐静脉和上肺静脉)代表了另一种可行的选择。奇静脉壁显示出足够的机械特性,但仅在右侧手术的情况下才能进行,并且通常会产生有限数量的组织。相反,在左上肺叶切除术中通常可以使用上肺静脉补片,因为解剖学原因使其在右侧不常见。当PA的实质外部分没有肿瘤时,通过结扎PV分支,然后在靠近心包反折的静脉近端部分应用胸腹(TA)线性血管吻合器,可以分离高达2 cm的上肺静脉管。静脉横断后,可以通过修剪 PV 导管轻松获得补片。上肺静脉表现出与 PA 组织相似的特性,因此代表了一种合适的重建材料。隐静脉的情况并非如此,隐静脉需要一个单独的手术来采集,并且在其内皮表面有静脉瓣。
一旦贴片被收集并适当地剪裁,它就会通过两根缝合线固定在动脉壁上,这些针线应用于血管缺损的相对点。缝线(5-0 或 6-0 单丝不可吸收材料)以自上而下连续缝合,然后再回到顶部,同时助手抓住并拉伸补片(图5)。下缝线不打结:它仅用于将补片固定到位,直到缝合线达到其水平。对于必须进行联合支气管重建的患者,通常首先进行 PA 补片吻合以减少夹闭时间。
肺复张后,必须再次检查血管缝线水平的止血情况,因为PA表面张力的变化可能会因补片边缘回缩而导致出血,尤其是采用新鲜的自体心包时。
PA 袖状切除术
当肿瘤累及血管全周的一半或更多时,需要进行PA袖状切除术。在这种情况下,血管残端之间的口径差异和意外牵引是主要的技术问题。分割动脉时,建议在两个血管残端上获得规则的横断边缘和均匀的内皮表面,即使以损失一些组织为代价。这有助于准确放置缝线以获得均匀的缝合。如果发生大口径差异,均匀的边缘也可以促进纠正。吻合是通过 5-0 或 6-0 单丝不可吸收材料连续缝合进行的;缝合必须非常小心以避免术后肺动脉狭窄。为了重建手术的最终成功,实现无张力的吻合至关重要。可以通过切开下肺韧带或在右侧打开下肺静脉周围的心包来降低张力。
在那些同时进行气管重建手术的患者中,支气管袖状切除术会导致支气管轴缩短,从而以通常可接受的张力更容易地接近血管残端。最后进行端到端 PA 缝合,从而最大限度地减少对重建血管的操作。事实上,在完成支气管吻合后,两个动脉末端之间的距离显着减小,可以通过在缝合时抬高下叶进一步减小。恢复血流和移除近端夹钳通常可以缓解任何残余张力。然而,如果尽管采取了这些措施,两个动脉残端之间的距离仍然明显,则应考虑假体导管。
有时,可能需要对主 PA 的进行独立的袖状切除术。这通常会导致两个血管残端之间的距离过大,随后在吻合部位产生高张力。这种技术情况可能会发生,通常发生在左侧,因为叶支气管没有肿瘤侵犯,需要切除长部分 PA 而不进行相关的支气管袖状切除术。在这些零星病例中,血管重建不能通过直接的端端吻合,需要假体导管。
虽然这些情况并不常见,但多年来已经提出了几种用于剪裁和更换血管的材料和技术。生物材料是首选,因为它们具有较高的生物相容性和术后血栓形成的风险较低。在这个问题上,作者之前曾报道过使用自体心包获得令人满意的结果 [19,20]。最近,我们还实施了异源心包(牛和猪)作为替代品 [17]。当使用自体心包时,心外膜表面位于导管腔内。根据目前作者的术中操作,将心包修剪成矩形,缠绕在胸管或适当直径的注射器上,纵向缝合。在我们最初的经验中,这种缝合是用 6-0 单丝不可吸收材料手动进行的。最近,我们提出了一种技术替代方案,其中包括使用机械线性缝合器纵向缝合心包导管。
最近引入了一个有趣的替代动脉导管的选择是肺实质外部分的上肺静脉[21,22]。可以从切除的上叶获取没有被肿瘤累及的血管。获得长达 20 毫米的肺静脉管的技术已进行了描述。静脉导管是 PA 替代物的理想替代品,因为它具有足够的厚度、与动脉壁的结构相似。建议根据切除的动脉段来确定生物导管的长度,因为这两种组织的弹性是一样的。
置换时,先完成近端缝合线(单丝材料);一旦导管长度确定,远端缝合就可以用相同的技术完成。避免导管过长,这可能会导致血管扭结,影响血液流动,从而导致血栓形成。
最后的考虑
支气管成形术和肺动脉成形术联合肺叶切除术,虽然在技术上相对标准的肺切除术要求高,但疗效与 PN 相当,甚至更好 [1-4,6,7,23-30]。
目前的文献结果支持支气管血管重建手术越来越广泛地用于治疗位于中央的肺肿瘤,即使是肺功能正常的患者。这些外科手术不但可以达到与PN相同的肿瘤根治效果,还具有标准肺叶切除术保留肺功能的优势,包括诱导化疗后进行的手术。 在计划此类手术时,必须对肿瘤范围进行全面的术前评估、仔细的手术技术和严格的围手术期管理,以便用最低的成本为患者获得最佳的结果。
Acknowledgments
Funding: None.
Footnote
Conflicts of Interest: The authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Park JS, Yang HC, Kim HK, et al. Sleeve lobectomy as an alternative procedure to pneumonectomy for non-small cell lung cancer. J Thorac Oncol 2010;5:517-20. [Crossref] [PubMed]
- Shi W, Zhang W, Sun H, et al. Sleeve lobectomy versus pneumonetomy for non –small cell lung cancer. World J Surg Oncol 2012;10:265. [Crossref] [PubMed]
- Maurizi G, D’Andrilli A, Anile M, et al. Sleeve lobectomy compared with pneumonectomy after induction therapy for non-small lung cancer. J Thorac Oncol 2013;8:637-43. [Crossref] [PubMed]
- Nagayasu T, Yamasaki N, Tsuchiya T, et al. The evolution of bronchoplasty and broncho-angioplasty as treatments for lung cancer. Evolution of 30 years of data from a single institution. Eur J Cardiothorac Surg 2016;49:300-6. [Crossref] [PubMed]
- Maurizi G, Rendina EA. Bronchovascular reconstructions for lung cancer: improvements over time. Eur J Cardiothorac Surg 2016;49:306-7. [Crossref] [PubMed]
- Takeda S, Maeda H, Koma M, et al. Comparison of surgical results after pneumonectomy and sleeve lobectomy for non-small cell lung cancer: trends over time and 20-year institutional experience. Eur J Cardiothorac Surg 2006;29:276-80. [Crossref] [PubMed]
- Gómez-Caro A, Garcia S, Reguart N, et al. Determining the appropriate sleeve lobectomy versus pneumonectomy ratio in central non-small cell lung cancer patients: an audit of an aggressive policy of pneumonectomy avoidance. Eur J Cardiothorac Surg 2011;39:352-9. [Crossref] [PubMed]
- Ciccone AM, D’Andrilli A, Venuta F, et al. Imaging of tumor infiltration of the pulmonary artery amenable to sleeve resection. J Thorac Cardiovasc Surg 2008;136:229-30. [Crossref] [PubMed]
- Mahtabifard A, Fuller CB, McKenna RJ Jr. Vido-assisted thoracic surgery sleeve lobectomy: a case series Ann Thorac Surg 2008;85:S729-32. [Crossref] [PubMed]
- Gonzalez-Rivas D, Fernandez R, Fieira E, et al. Uniportal video-assisted thoracoscopic bronchial sleeve lobectomy: first report. J Thorac Cardiovasc Surg 2013;145:1676-7. [Crossref] [PubMed]
- Fadel E, Yldizeli B, Chapelier A, et al. Sleeve lobectomy for bronchogenic cancers: factors affecting survival. Ann Thorac Surg 2002;74:851-8. [Crossref] [PubMed]
- Rendina EA, Venta F, Ciriaco P, et al. Bronchovascular sleeve resection. Technique, perioperative management, prevention and treatment of complications. J Thorac Cardiovasc Surg 1993;106:73-9. [PubMed]
- Maurizi G, Ciccone AM, Vanni C, et al. Reimplantation of the upper lobe bronchus after lower sleeve lobectomy or bilobectomy: long-term results. Eur J Cardiothorac Surg 2018;53:1180-5. [Crossref] [PubMed]
- Rendina EA, Venuta F, Ricci P, et al. Protection and revascularization of bronchial anastomoses by the intercostal pedicle flap. J Thorac Cardiovasc Surg 1994;107:1251-4. [PubMed]
- Tsuchiya R. Bronchoplastic techniques. In: Patterson GA, Deslauriers J, Lerut A, et al. editors. Pearson’s Thoracic and Esophageal Surgery 2nd ed. Philadelphia, PA: Churchill Livingstone, 2002:1005.
- Ricci C, Rendina EA, Venuta F, et al. Reconstruction of the pulmonary artery in patients with lung cancer. Ann Thorac Surg 1994;57:627. [Crossref] [PubMed]
- D'Andrilli A, Maurizi G, Ciccone AM, et al. Long-segment pulmonary artery resection to avoid pneumonectomy: long-term results after prosthetic replacement. Eur J Cardiothorac Surg 2018;53:331-5. [Crossref] [PubMed]
- D’Andrilli A, Ibrahim M, Venuta F, et al. Glutaraldhehyde preserved autologous pericardium for patch reconstruction of the pulmonary artery and superior vena cava. Ann Thorac Surg 2005;80:357-8. [Crossref] [PubMed]
- Rendina EA, Venuta F, De Giacomo T, et al. Reconstruction of the pulmonary artery by a conduit of autologous pericardium. J Thorac Cardiovasc Surg 1995;110:867-8. [Crossref] [PubMed]
- Venuta F, Ciccone AM, Anile M, et al. Reconstruction of the pulmonary artery for lung cancer: long-term results. J Thorac Cardiovasc Surg 2009;138:1185-91. [Crossref] [PubMed]
- Cerezo F, Cano JR, Espinosa D, et al. New technique for pulmonary artery reconstruction. Eur J Cardiothorac Surg 2009;36:422-3. [Crossref] [PubMed]
- D’Andrilli A, Maurizi G, Andreetti C, et al. Pulmonary artery reconstruction with pulmonary vein conduit for lung cancer: medium-term results. Ann Thorac Surg 2014;98:990-5. [Crossref] [PubMed]
- Okada M, Yamagashi H, Stak S, et al. Survival related to lymph node involvement in lung cancer after sleeve lobectomy compared with pneumonectomy. J Thorac Cardiovasc Surg 2000;119:814-9. [Crossref] [PubMed]
- Deslauriers J, Grégoire J, Jacques LF, et al. Sleeve lobectomy versus pneumonectomy for lung cancer: a comparative analysis of survival and sites of recurrence. Ann Thorac Surg 2004;77:1152-6. [Crossref] [PubMed]
- Ludwig C, Stoelben E, Olschewski M, et al. Comparison of morbidity, 30-day mortality, and long term survival after pneumonectomy and sleeve lobectomy for non-small cell lung carcinoma. Ann Thorac Surg 2005;79:968-73. [Crossref] [PubMed]
- Bagan P, Berna P, Pereira JC, et al. Sleeve lobectomy versus pneumonectomy: tumor characteristics and comparative analysis of feasibility and results. Ann Thorac Surg 2005;80:2046-50. [Crossref] [PubMed]
- Kim Y T, Kang CH, Sung SW, et al. Local control of disease related to lymph node involvement in non-small cell lung cancer after sleeve lobectomy compared with pneumonectomy. Ann Thorac Surg 2005;79:1153-61. [Crossref] [PubMed]
- Melloul E, Egger B, Krueger T, et al. Mortality, complications and loss of pulmonary function after pneumonectomy vs. sleeve lobectomy in patients younger and older than 70 years. Interact Cardiovasc Thorac Surg 2008;7:986-9. [Crossref] [PubMed]
- Ma Z, Dong J, Fan J, et al. Does sleeve lobectomy concomitant with or without pulmonary artery reconstruction (double sleeve) have favorable results for non-small cell lung cancer compared with pneumonectomy? A meta-analysis. Eur J Cardiothorac Surg 2007;32:20-8. [Crossref] [PubMed]
- D'Andrilli A, Maurizi G, Andreetti C, et al. Sleeve Lobectomy Versus Standard Lobectomy for Lung Cancer: Functional and Oncologic Evaluation. Ann Thorac Surg 2016;101:1936-42. [Crossref] [PubMed]

张正
烟台毓璜顶医院。胸外科医师,外科学博士。2015获得同济医院外科学唯一专业型临床转博资格,2018年取得外科学临床型博士学位。2018年被烟台市作为高层次短缺人才引进,现就职于青岛大学医学院附属烟台毓璜顶医院胸外科。在临床和科研上均得到系统规范锻炼,曾多次参加全国胸心血管年会并进行大会发言五次。曾获得华中科技大学优秀毕业研究生、国家研究生奖学金、同济医院研究生十佳论文等称号。以第一作者或共同第一作者的研究论著发表在Annals of Thoracic Surgery、Diseases of the Esophagus、Journal of Experimental & Clinical Cancer Research、Journal of Thoracic Disease、中华胸心血管外科杂志、中国胸心血管外科临床杂志等国内外权威期刊上。(更新时间:2021/9/8)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Maurizi G, Vanni C, D’Andrilli A, Ciccone AM, Ibrahim M, Andreetti C, Menna C, Poggi C, Venuta F, Rendina EA. Bronchoplasty and pulmonary arterioplasty. Curr Chall Thorac Surg 2019;1:3.