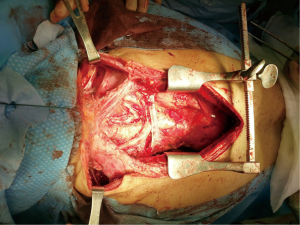
前上纵隔扩大切除术
引言
纵隔是胸腔内的一个复杂结构,由多种器官、结构和结缔组织组成,因此很容易受多种疾病影响。纵隔通常被分成几个特定的膈室。这种看似随意的划分有助于病情初期的鉴别诊断,也有助于治疗计划的拟定[1]。在经典解剖学分类中,纵隔被分为前、上、中、后四个区域。因为许多疾病会同时影响前纵隔和上纵隔,所以这两个区域通常被被描述为一个单独的解剖区域。前上纵隔是多种肿瘤的发源地,其主要细胞成分来源于胸腺、淋巴结,极少数来自异位组织和胚胎残留物[2]。正如Takeda等报道的,纵隔肿瘤最常见的部位是前上纵隔,占成人纵隔肿瘤的68%,而后纵隔肿瘤在儿童中更常见[3]。儿童和成人肿瘤具有不同的人口学、临床和组织学特征。婴幼儿原发性纵隔肿瘤的发生率依次为神经源性肿瘤、生殖细胞肿瘤(GCTs)和心包或肠源性囊肿[4]。成人前上纵隔最常见的原发性肿瘤是胸腺瘤,占纵隔肿块的50%以上,其次是淋巴瘤、GCT和甲状旁腺腺瘤,这三种很少需要扩大切除。前上纵隔经常会涉及大的转移淋巴结,特别是在晚期肺癌和甲状腺癌中。由于纵隔肿瘤,特别是巨大纵隔肿瘤非常罕见,占所有肿瘤的不到5%,所以少有文献报道。由于纵隔解剖结构复杂,前上纵隔的巨大肿瘤对外科医生的诊断和治疗提出了挑战,特别是在肿瘤压迫或浸润重要周围结构的情况下,挑战就更加严峻[5]。由于纵隔间隙狭窄,所有涉及前纵隔的肿瘤中,高达60%的肿瘤出现症状是由于邻近器官的机械性压迫或浸润[6](表1)。此外,一些患者的治疗可能会因纵隔肿瘤综合征(MMS)而进一步复杂。MMS是一种由于气道阻塞和心脏、大血管受压导致的以急性呼吸和血流动力学衰竭为特征的危及生命的综合征。而手术中的麻醉诱导或体位改变可能会加剧这种危及生命的状况[7]。因此,彻底的术前检查对评估肿块的解剖结构、明确肿瘤与周围纵隔结构的毗邻关系以及最终手术详细计划的制定都是至关重要的。不要忘记临床症状和(或)检查,以排除与纵隔肿块相关的潜在副肿瘤综合征。

Full table
术前评估
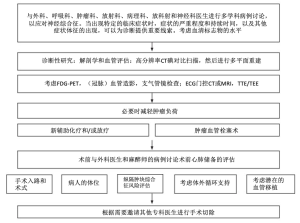
大多数情况下,纵隔的解剖学评估是通过胸部计算机断层扫描(CT)进行的。CT检查可以从病灶位置、与毗邻结构的关系等方面详细定义肿瘤的特征。此外,静脉造影能够重点突出血管走行[8]。必要时,应进行进一步检查以确定肿瘤与其他结构的关系。磁共振成像(MRI)在软组织鉴别和评估胸壁侵犯方面更有优势。经胸超声心动图(TTE)、经食管超声心动图(TEE)和近期的心电图(ECG)门控心脏CT和MRI可以通过减少心脏运动伪影从而改善对组织压迫和心脏或大血管受累情况的评估[9,10]。氟脱氧葡萄糖正电子发射断层扫描 (FDG-PET)在对纵隔肿瘤的诊断评估中具有基础性作用,主要体现在诊断,分期和预后这三个方面,但其在纵隔的解剖学评估中作用有限[11];而气管-支气管树可以通过支气管镜检查得到彻底的评估,这种检查也可以在手术中进行[12]。巨大纵隔肿瘤通常血运非常丰富,术中出血风险和手术复杂程度非常高。瘤灶供血极其复杂,其可能来自内乳动脉、支气管动脉、甲状颈干、肋间血管、膈神经血管、肺动脉,甚至冠状动脉[13-15]。MRI和CT造影可以提供肿瘤血运的详细信息,如果侵犯上腔静脉(SVC),还可以提供侧支循环的详细信息[16]。最近,一些学者主张将影像引导下的肿瘤血管栓塞作为一种有效的术前治疗手段,以减少术中出血,同时可以部分缩小肿瘤肿块。但是目前还没有关于这方面的大型临床研究[17,18]。应当注意的是当前纵隔肿瘤边界清楚、较易完全切除时,应尽量避免术前活检,以减少播散种植的可能性。另一方面,这种方法不适用于表现为无法手术切除的巨大肿块,而新辅助治疗可以提高可切除性并且能通过“释放”周围受累组织结构来促进手术切除。胸腺瘤和原发性纵隔非精原细胞瘤GCTs对放化疗都很敏感。当表现为巨大纵隔肿块时,可选择综合治疗手段,联合新辅助化疗或放疗,然后手术切除残留病灶。此外,大多数淋巴增生性恶性肿瘤应完全接受系统性化疗方案。细针抽吸(FNA)、芯针活检或更具侵入性的手术活检(包括前纵隔切开、纵隔镜和电视胸腔镜)获得的组织病理学诊断都与术前治疗的作用和效果息息相关。其他检查如实验室检查中常见的甲胎蛋白(α-FP),β-人绒毛膜促性腺激素(β-hCG),用于非精原细胞瘤GCT诊断的乳酸脱氢酶(LDH),以及用于重症肌无力综合征相关胸腺瘤诊断的抗乙酰胆碱受体抗体和抗肌特异性酪氨酸激酶抗体等都可以发挥重要作用。2016年Li等人提出了一个很好的改进方案[5](图1)。
技术层面
在纵隔肿块较大的情况下,为了实现对所有可能涉及的解剖结构的全面掌控从而避免重大并发症的发生,必须有充分的暴露。胸骨切开术是治疗前纵隔肿瘤的最佳入路,即使在肺部受累的情况下也应选择此入路。所有双侧肺实质、主气道或所有大血管、心包的手术均可通过该入路完成。并且,无论何时需要建立体外循环(ECC),胸骨切开都是必不可少的。这种中线入路可以扩展到胸廓切开术(半蛤壳切口),也可以在必要时与宫颈切开术相结合(图2)。很少有其他术式被描述为开胸或蛤壳状切口,微创技术应只考虑用于诊断目的,而不用于根治性手术,特别是对于大于10 cm的肿瘤[5,19]。前上纵隔扩大切除术的主要目标是尽可能彻底清除肿瘤。纵隔肿块切除的绝对禁忌是侵犯心肌,是否累及大血管或长气管段应逐一评估。如果可能,任何浸润的结构都应该切除、重建。肺实质可以很容易地切除,小到从使用切割闭合器的楔形切除到肺叶切除,大到全肺以及纵隔胸膜和心包切除(当肺门被侵犯时需要心包内缝合)。在大的心包切除术中,应始终放置人工补片,以避免心脏通过缺损进入胸腔的可能性,特别是在全肺切除术后。虽然膈神经必须至少保留一侧,但在被侵犯时通常会被牺牲,特别是在计划进行全肺切除的情况下。但一些学者报道了一种有效的技术,通过轻轻剥离神经周围层来保护神经,以避免产生进一步的呼吸并发症,特别是在肺功能受损或重症肌无力的患者中这种技术优势明显[20]。在大血管中,上腔静脉和头臂静脉是最常见的受累血管,往往受累程度不同,从部分压迫或侵犯,到静脉被肿瘤完全闭塞,此时就会发展成上腔静脉综合征(SVC syndrome,SVCS)。一般来说,当肿瘤广泛侵犯或血管闭塞超过50%或缝合不能时,多数学者主张用人工血管或静脉移植物进行全上腔静脉置换术[21]。很多学者建议应避免直到广泛血栓侵犯锁骨下静脉时才进行SVC重建,因为此时血栓栓塞的风险很高,或者存在弥漫性侧支静脉循环。相反早期如果只有一条头臂静脉受到肿瘤侵袭,即使不需要置换也可以安全切除[22]。包括切除和重建上腔静脉在内的扩大切除术对临床医生是一个重大的技术挑战。特别是由于夹闭通畅血管产生的潜在不良影响,手术中有必要与麻醉医生密切合作共同管理患者的血流动力学,如维持高脑灌注压和使用肝素来预防潜在的严重并发症。最近,一些学者报道了ECC或体外体膜氧合(ECMO)在纵隔肿块外科治疗中的应用[23,24]。有了这些设备的辅助,即使在肺萎陷的情况下,也能提供足够的血运和呼吸功能。同时,降低呼吸和血液动力学失代偿的风险有助于病灶的切除。然而,中心插管可能会缩小手术视野,因此应首选股血管外周插管或ECMO。而这些设备所需的全身肝素化可能会增加肿瘤切除过程中出血性并发症以及恶性肿瘤细胞扩散的风险。因此术前应逐个进行多学科风险评估,判断ECC的必要性。
晚期胸腺瘤
胸腺瘤以纵隔大肿块的形式出现的通常是Masaoka-Koga III 期肿瘤,占所有手术治疗胸腺瘤的30%。多累及心包、肺实质、大血管、膈神经、膈肌、胸壁等胸腔脏器结构。由于其临床病理行为的罕见性和高度变异性其治疗目前远未标准化[25]。在既往多数的病例报道中,切除是否完全已被认为是提高局部控制率和延长生存相关的主要预后因素,但是根治性切除率差异很大 (从50%~80%不等) [26,27]。正如Attaran及其同事所阐述的那样,肉眼可见不完全切除或减瘤手术会增加复发率从而带来较差的预后,与单独活检相比没有任何优势。有几篇关于胸腺恶性肿瘤的扩大切除术和重建手术的文献报道称在生存和基本局部控制方面取得了优异的结果。术中头臂静脉、SVC、肺、心包、右心房和膈肌均安全切除(伴或不伴重建)从而提高了完全切除率,同样的在某些病例中,可能需要切除和重建主动脉和主肺动脉,以实现完全切除[1]。最近,欧洲心胸外科协会的一项调查显示,在胸腺瘤的治疗中有一种新辅助治疗方案(化疗和/或放疗)被提出,目的是达到术前病灶体积缩小,达到完全切除。其诱导治疗后完全切除率达到92%,5年总生存率(OS)达到80%[27]。除了关注诱导治疗的效果外,外科医生的主要目标应该是全胸腺扩大切除术,包括切除肿瘤以及任何受侵的毗邻结构,尤其是在涉及大血管的III期胸腺瘤(发生率从8.9%~24.8%) [21,25]。然而,与根治性切除侵犯周围其他结构的患者相比,涉及大血管(头臂静脉、SVC,极少的主动脉和腹主动脉血管)的III期胸腺瘤的5年生存率更低(45%~56%) [27]。这种较大差异的原因可能与术中严重并发症、较高的全身复发风险,以及再次切除的机会有限有关[21]。对于胸腺瘤累及膈神经者,一些学者主张先进行保留神经的手术,然后再进行放射治疗,以避免呼吸道并发症,尤其是对肌无力的患者适用[20]。
纵隔淋巴瘤
恶性淋巴瘤作为播散性疾病的一部分或原发病变可累及前上纵隔。最常见的原发性纵隔淋巴瘤是霍奇金氏病(通常为结节性硬化型)、大细胞淋巴瘤(常合并硬化症)、肺粘膜相关淋巴组织淋巴瘤和淋巴母细胞淋巴瘤(常与急性淋巴母细胞白血病合并)[28]。不同亚型的临床表现可能相似,因为这些肿瘤大多表现为大的侵袭性前纵隔肿块,同时可能累及周围组织结构。不同化疗方案和放射治疗的密集结合是纵隔淋巴瘤的主要治疗方式,当FNA或空心针穿刺活检等侵入性较小的方法不能确定时,手术大多局限于诊断性活检。此外,一些学者主张在系统治疗后,通过手术切除残留肿块。正如Bacha和他的同事报道的,切除这类肿块有三个特别的目的:阐明进一步治疗的需要,消除肿瘤细胞的任何残留,以及在肿瘤完全切除后减少辅助放射治疗的需要[19]。
生殖细胞瘤 (GCTs)
纵隔生殖细胞瘤是一种罕见的肿瘤,约占纵隔肿瘤的5%。这些肿瘤在组织学上与性腺肿瘤含有相同的成分。因为它们是胚胎发生期间沿尿生殖嵴发育停止的生殖细胞恶性转化的结果,但可能表现出不同的生物学行为、临床特征以及整体不良的预后。它们在组织学上可分为三类:成熟性畸胎瘤、精原细胞瘤型GCT和非精原细胞瘤型GCT[29]。成熟性畸胎瘤约占所有纵隔GCTs的60%,其特征是成熟组织来源于骨、软骨、脂肪,鳞状上皮和腺上皮三个生发层,这些组织在CT扫描上很容易被鉴别。这类肿瘤与α-FP、β-HCG等血清标志物的升高无相关性。畸胎瘤的行为千差万别:大多数畸胎瘤表现为惰性行为,主要风险是与周围组织结构黏连。但一些成熟畸胎瘤生长更快,可能退化为非生殖细胞肿瘤,如肉瘤和上皮癌[30]。由于成熟畸胎瘤对化疗或放射治疗不敏感,手术是主要治疗方法,可以在完全切除后获得良好肿瘤学结果。然而手术切除有时是极具挑战的,特别是在肿块大于5cm或累及邻近器官的情况下。据估计,大约15%的患者需要扩大切除至其他结构(例如联合肺叶切除术、心包切除术)才能完全切除肿瘤。
精原细胞瘤GCTs
原发性纵隔精原细胞瘤是一种罕见的肿瘤,通常发生20到40岁的男性。典型病变表现为分叶状、均匀的肿块,在生长过程的早期易于浸润到周围结构。虽然约40%的患者中可以发现高水平的β-HCG,但患者中血清肿瘤标志物通常是正常的。通常情况下,超过三分之一的纵隔精原细胞瘤患者在诊断时已经有局部性疾病,而其余患者至少有一处远处部位转移。单纯的精原细胞瘤对化疗和放疗敏感,预后一般良好[31]。目前尚无关于初次手术潜在益处的结论性数据,外科手段在临床上通常是不可行的,主要是因为这种疾病很少被诊断为具有非纵隔外侵犯的小纵隔肿块。即使在诊断时已经发生转移,单纯纵隔精原细胞瘤在大多数患者中是可以治愈的,可选择化疗和放射治疗相结合的治疗方法[32]。已有研究表明,化疗后残留肿块往往不含存活的肿瘤细胞,因此建议仅对大于3 cm并在监测期间有增加的趋势的残留肿块进行手术治疗。
非精原细胞瘤型GCTs
非精原细胞瘤比精原细胞瘤更常见,包括三种组织亚型(单独或合并):卵黄囊瘤、胚胎癌和绒毛膜癌[30]。这些肿瘤会表现出侵袭性行为,通过压迫或侵犯局部纵隔结构在很短的时间内引发症状。超过85%的患者在诊断时至少存在一处转移性病变。CT扫描可见肺、上腔静脉、无名静脉、心包等邻近结构的浸润,偶尔还可见于其他大血管和心脏。血清肿瘤标志物(α-FP和β-HCG)常见异常,其水平的升高结合典型CT征象,即使不经活检也可诊断原发性恶性非精原细胞瘤[32]。受纵隔非精原细胞瘤影响的患者中,大约5%~10%与Klinefelter综合征有关,更罕见的是这些患者会出现各种血液肿瘤。同平均5年存活率几乎为50%的其他GCTs相比,非精原细胞瘤型GCTs的预后较差。对于非精原细胞瘤型GCTs,手术的作用非常有限,但其他治疗方式的疗效会更好,在这些患者中多模态治疗策略是极其重要的。大多数患者在化疗结束后仍有纵隔的影像学异常。如果技术允许,应该对残留肿块进行根治性手术切除,三分之一的患者有可能获得治愈[33]。
转移性淋巴结
纵隔淋巴结转移多见于晚期肺癌、甲状腺癌,少见于食管癌、胰腺癌、结直肠癌和乳腺癌。III期非小细胞肺癌(NSCLC)描述了原发肿瘤向同侧和(或)对侧纵隔淋巴结的转移扩散,包括多种病症,如从单站未被怀疑的N2病症到无法解剖的肿大侵袭性的N2或N3病症[34]。大淋巴结节疾病通常被定义为胸部CT测量的短轴直径大于2 cm的受累淋巴结,通常意味着淋巴结外受累,多站淋巴结疾病,和(或)多个阳性小淋巴结分组[35]。对于不能切除的N2或N3 NSCLC,同步放化疗被广泛的作为治疗标准,而手术的作用在极少数报道中被作为多模态治疗的一部分,但其有效性仍远未得到认可[36,37]。甲状腺癌主要由3种组织学类型组成:乳头状癌、滤泡状癌和髓样癌。这3种癌的转移方式不同。滤泡状癌主要转移到远处器官,如肺和骨。虽然仅有9%的甲状腺癌被发现有上纵隔淋巴结转移,但乳头状癌和髓样癌的淋巴结转移率很高,达到30%-80%。甲状腺癌通常形成三个区域的淋巴转移:中央、侧壁和纵隔。到目前为止,关于中央和侧方淋巴结转移的研究很多。然而,甲状腺癌纵隔淋巴结清扫的适应证和范围还没有明确界定[38]。在这些情况下,精准的多学科评估必不可少,并且在全身治疗失败的情况下,无论是初始治疗或复发病灶的再次手术,大多数研究者主张都应将转移性纵隔淋巴结清扫术作为甲状腺癌的有效治疗方法[39]。甲状腺髓样癌细胞对放射性碘和激素治疗不敏感,手术是治疗或姑息治疗的最佳选择。此外,在癌细胞转移的情况下,初次手术不彻底降钙素水平升高的患者或者有复发的影像学证据,都应考虑二次手术。再次手术能够降低严重压迫及侵犯气道或主要血管的风险。有经验的医生通过局部病灶的再手术可以实现疾病的长期控制,多达1/3患者的生存率得到提高[40]。
结论
前上纵隔肿块的扩大切除术对外科医生和麻醉医生来说是一个真正的挑战,从诊断初始就应一步一步地进行周密的计划。主要目标是获得肿瘤的完全切除,这也是主要的预后因素,从而获得满意的长期生存率。围手术期管理的外科技术的发展、新一代人工材料的应用以及ECC和ECMO的日益普及,使这类手术成为一种可行、安全、有效的手术方式。对这些恶性肿瘤患者的集中护理可以提高护理质量,也意味着更好的手术和肿瘤学结果。对肿瘤的术前评估和术中处理是具有挑战性的,一个有针对性的多学科方法是必不可少的。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Francesco Zaraca, Reinhold Perkmann, Luca Bertolaccini and Roberto Crisci) for the Focused Issue “Thoracic Surgery Without Borders” published in Current Challenges in Thoracic Surgery. The article was sent for external peer review organized by the Guest Editors and the editorial office.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/ccts.2019.11.10). The Focused Issue “Thoracic Surgery Without Borders” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- D’andrilli A, Rendina EA, Venuta F. Anterior mediastinal lesions. In: Kaiser LR, Jamieson G, Thompson SK. editors. Operative thoracic surgery. 6th ed. Boca Raton: CRC Press, 2017.
- Marino M, Ascani S. An overview on the differential diagnostics of tumors of the anterior-superior mediastinum: the pathologist’s perspective. Mediastinum 2019;3:6. [Crossref]
- Takeda S, Miyoshi S, Akashi A, et al. Clinical spectrum of primary mediastinal tumors: a comparison of adult and pediatric populations at a single Japanese institution. J Surg Oncol 2003;83:24-30. [Crossref] [PubMed]
- Liu T, Al-Kzayer LFY, Xie X, et al. Mediastinal lesions across the age spectrum: a clinicopathological comparison between pediatric and adult patients. Oncotarget 2017;8:59845-53. [PubMed]
- Li WW, van Boven WJ, Annema JT, et al. Management of large mediastinal masses: surgical and anesthesiological considerations. J Thorac Dis 2016;8:E175-84. [Crossref] [PubMed]
- Mullen B, Richardson JD. Primary anterior mediastinal tumors in children and adults. Ann Thorac Surg 1986;42:338-45. [Crossref] [PubMed]
- Davis RD Jr, Oldham HN Jr, Sabiston DC Jr. Primary cysts and neoplasms of the mediastinum: recent changes in clinical presentation, methods of diagnosis, management, and results. Ann Thorac Surg 1987;44:229-37. [Crossref] [PubMed]
- Tomiyama N, Honda O, Tsubamoto M, et al. Anterior mediastinal tumors: diagnostic accuracy of CT and MRI. Eur J Radiol 2009;69:280-8. [Crossref] [PubMed]
- Biederer J, Mirsadraee S, Beer M, et al. MRI of the lung (3/3)-current applications and future perspectives. Insights Imaging 2012;3:373-86. [Crossref] [PubMed]
- D’Cruz IA, Feghali N, Gross CM. Echocardiographic manifestations of mediastinal masses compressing or encroaching on the heart. Echocardiography 1994;11:523-33. [Crossref] [PubMed]
- Rankin S. [(18)F]2-fluoro-2-deoxy-D-glucose PET/CT in mediastinal masses. Cancer Imaging 2010;10 Spec no A:S156-60.
- Kuperberg SJ, Morris BN, Bellinger CR. Anesthetic safety during adult bronchoscopic evaluation of mediastinal masses. Clinical Pulmonary Medicine 2017;24:220-3. [Crossref]
- Andreini D, Pontone G, Dainese L, et al. Preoperative assessment of thymoma: evaluation of mediastinal arterial anatomy by cardiac multidetector computed tomography. J Thorac Imaging 2009;24:31-3. [Crossref] [PubMed]
- Morandi U, Stefani A, De Santis M, et al. Preoperative embolization in surgical treatment of mediastinal hemangiopericytoma. Ann Thorac Surg 2000;69:937-9. [Crossref] [PubMed]
- Allred JD, Mehta D, Courville KA, et al. Mediastinal mass with blood supply from the coronary arteries. Clin Cardiol 2009;32:E49. [Crossref] [PubMed]
- Eren S, Karaman A, Okur A. The superior vena cava syndrome caused by malignant disease. Imaging with multi-detector row CT. Eur J Radiol 2006;59:93-103. [Crossref] [PubMed]
- Rakovich G, Ferraro P, Therasse E, et al. Preoperative embolization in the management of a mediastinal paraganglioma. Ann Thorac Surg 2001;72:601-3. [Crossref] [PubMed]
- Liu FY, Wang MQ, Fan QS, et al. Interventional embolization of giant thoracic tumors before surgical resection. Acta Radiol 2013;54:61-6. [Crossref] [PubMed]
- Bacha EA, Chapelier AR, Macchiarini P, et al. Surgery for invasive primary mediastinal tumors. Ann Thorac Surg 1998;66:234-9. [Crossref] [PubMed]
- Aprile V, Bertoglio P, Korasidis S, et al. Nerve-sparing surgery in advanced stage thymomas. Ann Thorac Surg 2019;107:878-84. [Crossref] [PubMed]
- Leuzzi G, Pastorino U. Extended surgical resection for stage III thymic tumors. Mediastinum 2018;2:40. [Crossref]
- Detterbeck FC, Parsons AM. Thymic tumors. Ann Thorac Surg 2004;77:1860-9. [Crossref] [PubMed]
- Vaporciyan AA, Rice D, Correa AM, et al. Resection of advanced thoracic malignancies requiring cardiopulmonary bypass. Eur J Cardiothorac Surg 2002;22:47-52. [Crossref] [PubMed]
- Wickiser JE, Thompson M, Leavey PJ, et al. Extracorporeal membrane oxygenation (ECMO) initiation without intubation in two children with mediastinal malignancy. Pediatr Blood Cancer 2007;49:751-4. [Crossref] [PubMed]
- Marulli G, Lucchi M, Margaritora S, et al. Surgical treatment of stage III thymic tumors: a multi-institutional review from four Italian centers. Eur J Cardiothorac Surg 2011;39:e1-7. [Crossref] [PubMed]
- Attaran S, Acharya M, Anderson JR, et al. Does surgical debulking for advanced stages of thymoma improve survival? Interact Cardiovasc Thorac Surg 2012;15:494-7. [Crossref] [PubMed]
- Lucchi M, Van Schil P, Schmid R, et al. Thymectomy for thymoma and myasthenia gravis. A survey of current surgical practice in thymic disease amongst EACTS members. Interact Cardiovasc Thorac Surg 2012;14:765-70. [Crossref] [PubMed]
- Strickler JG, Kurtin PJ. Mediastinal lymphoma. Semin Diagn Pathol 1991;8:2-13. [PubMed]
- Takeda S, Miyoshi S, Ohta M, et al. Primary germ cell tumors in the mediastinum: a 50-year experience at a single Japanese institution. Cancer 2003;97:367-76. [Crossref] [PubMed]
- Moran CA, Suster S. Primary germ cell tumors of the mediastinum: I. Analysis of 322 cases with special emphasis on teratomatous lesions and a proposal for histopathologic classification and clinical staging. Cancer 1997;80:681-90. [Crossref] [PubMed]
- Rosti G, Secondino S, Necchi A, et al. Primary mediastinal germ cell tumors. Seminars in oncology. Philadelphia: WB Saunders, 2019.
- Hainsworth JD, Greco FA. Primary germ cell tumors of the thorax. In: Kufe DW, Pollock RE, Weichselbaum RR, et al. Holland-Frei cancer medicine. 6th ed. Hamilton: BC Decker, 2003.
- Saxman SB, Nichols CR, Einhorn LH. Salvage chemotherapy in patients with extragonadal nonseminomatous germ cell tumors: the Indiana University experience. J Clin Oncol 1994;12:1390-3. [Crossref] [PubMed]
- Evison M, McDonald F, Batchelor T. What is the role of surgery in potentially resectable N2 non-small cell lung cancer? Thorax 2018;73:1105-9. [Crossref]
- Robinson LA, Ruckdeschel JC, Wagner H Jr, et al. Treatment of non-small cell lung cancer-stage IIIA: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007;132:243S-65S.
- Sakuraba M, Takahashi N, Oh S, et al. Long-term survival after complete mediastinal lymph node resection and lobectomy in patients with bulky N2 non-small cell lung cancer. Ann Thorac Cardiovasc Surg 2011;17:124-9. [Crossref] [PubMed]
- Yokomise H, Gotoh M, Okamoto T, et al. Induction chemoradiotherapy (carboplatin-taxane and concurrent 50-Gy radiation) for bulky cN2, N3 non-small cell lung cancer. J Thorac Cardiovasc Surg 2007;133:1179-85. [Crossref] [PubMed]
- Yamashita H, Masatsugu T, Uchino S, et al. Crank-shaped sternotomy for upper mediastinal lymph node dissection in patients with differentiated thyroid cancer. Surg Today 2004;34:480-1. [Crossref] [PubMed]
- Zhang TT, Qu N, Hu JQ, et al. Mediastinal lymph node metastases in thyroid cancer: characteristics, predictive factors, and prognosis. Int J Endocrinol 2017;2017:1868165. [Crossref] [PubMed]
- Jin LX, Moley JF. Surgery for lymph node metastases of medullary thyroid carcinoma: a review. Cancer 2016;122:358-66. [Crossref] [PubMed]

沈晓康
江苏省肿瘤医院胸外科。医学硕士,江苏省肿瘤医院胸外科医师。从事肺部肿瘤的基础和临床研究,参与国家自然科学基金、江苏省重大攻关项目等各类基金资助课题5项。近来以第一作者身份发表SCI文章3篇。获得江苏省卫健委新技术引进奖1项。参与完成胸腔镜下肺段切除术70例、胸腔镜下肺癌根治术60例、胸腔镜下食管癌根治术90例、胸腔镜下全胸腺切除术40例、体外循环建立4例。(更新时间:2021/9/8)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Aprile V, Korasidis S, Bacchin D, Ambrogi MC, Lucchi M. Extended surgery of antero-superior mediastinum. Curr Chall Thorac Surg 2019;1:21.