
胸壁受累的可切除肺癌预后因素
引言
在可切除的肺癌中,约有5%至8%的患者观察到支气管源性肿瘤累及胸壁[1]。在这些病例中,患者可能表现出不同程度的侵犯,从胸膜壁层浸润到胸壁全层侵犯,伴或不伴诸如肋间隙包括神经血管束、脊椎、纵膈血管结构以及胸外软组织等邻近解剖结构的累及。总体上,根据累及结构,这些支气管源性肿瘤被分为T3或T4[2]。在这种情况下,需要扩大切除,以最大限度地增加持久控制疾病的机会[3]。拆除和重建手术是治疗非小细胞肺癌(NSCLC)的主要方法(图1)。此外,增加多模式综合治疗的使用,包括化疗和放疗方案以及诱导免疫治疗,有望增加目前不合格、但在术前治疗后被认为有资格接收治疗性手术的患者数量。
肿瘤侵犯胸壁和纵膈淋巴结转移的患者预后较差。在不同系列研究中,T3N0的5年生存率在40%~50%之间,但在N1患者中这个数值减半,在N2患者中更是降至1/5[4,5]。
不同的预后因素在针对这些患者的文献中得到了一致的报道,其中包括肿瘤不完全切除、淋巴结受累(尤其是N2站)、胸壁侵入深度。然而,其他影响生存的因素的作用尚不清楚,许多问题仍未得到部分解答,包括多模式方案的有效作用以及辅助化疗或放疗对完全切除的胸壁侵犯且无淋巴结累及的NSCLC的影响[6-9]。
我们对文献进行了回顾,以识别出侵袭胸壁的NSCLC长期生存相关的预后因素。
正文
文献中最重要和最具代表性的预后因素是:
N0-N1/N2
不同的文献报道一致认为淋巴结受累和病理性淋巴结状态是最重要的预后因素[1,5-8,10-22]。研究的文献显示,同侧肺门(N1)或纵膈(N2)淋巴结转移影响5年生存率,如表1所示。
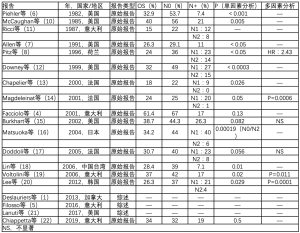
Full table
切除的完整性
切除后肿瘤组织残留和标本边缘未完全切除是另一个重要的预后因素[8,14,16,19,20]。手术治疗的基础是完全切除(R0)而不产生微观(R1)或宏观(R2)的阳性边缘。R1/R2切除是影响这些患者生存的一个负面因素,如表2所示。
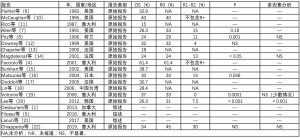
Full table
浸润深度
对于软组织侵袭伴或不伴有肋骨和胸壁受累,仅局限于胸膜壁层的连续受累影响生存率。值得注意的是,许多研究[13,14,19]报道局限于胸膜壁层的疾病预后较累及全层胸膜好。文献数据见 表3。
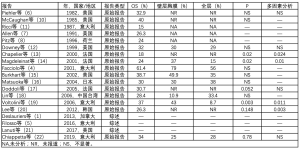
Full table
年龄
Piehler等[6]和Magdeleinat等[14]一致认为年龄>60岁对累及胸壁的非小细胞肺癌患者而言是一个不良预后因素。
肋骨切除数
其他作者发现,切除肋骨的数量是一个预后因素[1,13,17,21],尽管它可以被认为是一个与肿瘤大小相关的间接参数:确实,正如Lee等人[20]报道,直径>5cm与切除范围扩大有关。
切除肋骨的真实截断点目前也是一个有争议的问题:根据Chapelier等[13]和Doddoli等[17]的研究,这个肋骨切除数量的截断点可能是2根。
性别
Burkhart等[15]在他们的研究中报道,女性相比男性具有更高的5年生存率(52.9% vs. 31%, P=0.0122)。
在5-10%的病例中,支气管肿瘤伴有胸壁受累。手术切除是大多数侵犯胸壁的NSCLC患者治疗的关键因素,其技术可行性最早由Coleman[23]于1947年提出。无论pT还是pN,在不同系列研究中,这些患者的总体5年生存率在10%[5,11]到61.4%[4]之间。一些作者试图确定影响生存的各种因素。
在几乎所有的分析工作中发现,最重要的预后因素是病理性淋巴结状态[1,4,5-8,10-21]。淋巴结受累严重影响生存率。在不同的分析系列研究中,与N0[3-5]相比,在T3患者中,N2是一个降低生存率[12,13]的显著不良预后因素。T3N0和T3N2之间最显著的5年生存率差异(67.3% vs. 17.9%,P=0.007)见于Facciolo等的报道[4]。一般而言,pT3N0患者的中位5年生存率是50%;淋巴结转移降低了该比率,N1患者降至20%~25%,N2患者则低于10%[3,5]。如果我们考虑到与T3N2患者相比,具有寡转移病灶(脑或肾上腺)的IV期患者的预期寿命可能更好[24,25],这些结果可能更令人惊讶。淋巴结受累并不总是与肿瘤大小和胸壁浸润深度有关[3,24,25]。对一些作者而言,细胞学或组织学N2确认发现(EBUS,纵膈镜)意味着手术的强烈禁忌症[3]。根据目前的临床实践,对于可手术切除的T3肺癌,在有N2累及的情况下,采用新辅助化疗后再进行手术评估是一个有价值的选择[4]。然而,包括化疗和放疗在内的多模式治疗侵袭胸壁的肺癌的疗效仍有争议。除了肺上沟瘤新辅助放化疗是一种标准治疗方法[26,27]外,目前的指南确认手术是T3-4 N0-1 NSCLC的主要治疗方式,并限制放疗对不完全切除病例的使用。最有趣的是,间接证据表明T3N2 NSCLC患者术前放疗可能增加生存获益[28]。这是一个重要的问题:由于淋巴结分期是预后的主要决定因素[1,4,5-8,10-21],一些作者不建议在发现N2期疾病时进行手术切除[7,29],而其他人的经验[11,12,14,30]则基于手术患者提高5年生存率15%~21%为基础,认为纵膈淋巴结累及不应该被认为是手术的禁忌症。而最近的一项荟萃分析在可手术的IIIA患者中,对比诱导化疗后并未发现放化疗的益处[31],可以推测,在T3-4 N2患者亚群中,使用同步放化疗联合广泛切除可以能会增加完全切除率。
切除不完全是另一个预后因素[8,10,12,16,19,20]。众所周知,干净的手术边缘是外科治疗的主要目标,因为标本的病理性微观(R1)或宏观(R2)边缘可能会损害这些患者的生存。因此,在这些患者中R0和R1/R2切除的5年生存率分别为40.4%~58.3%和10.9%~15.9%[8,32,33]。根据Downey等人报道[12],不完全切除,即使是R1,也不能保证真正的疗效。不完全切除患者的3年生存率(4%)与完全不切除患者的3年生存率(0%)没有显著性差异。因此,切除的质量是实现长期生存的资本:Matsuoka等人[16]强调了完全切除的重要性,因为完全切除(5年生存率34.2%)和不完全切除(14.3%)患者之间的生存率在统计学上有显著差异。
其他两个主要的预后因素是切除的扩大(切除肋骨数量)[1,13,17,21]和浸润的深度[1,8,10,13,14,20,21]。它们可能会影响手术技术的选择[6-8,10-12],特别是当肿瘤侵袭范围未超出胸膜壁层时[14]。术前检查对于决定手术技术至关重要。目前,计算机断层扫描常用来评估胸壁侵犯情况[34];可供选择的影像检查方法还有外科医生实施的超声[34]或磁共振成像[35],尤其是加权序列(胸膜外脂肪组织破坏)或磁共振电影成像技术(呼吸运动时肿瘤固定)[35]。然而,胸部侵犯的评估主要依赖于术中对肿瘤粘附胸膜壁层的评估。一些作者总结出肿瘤侵犯局限于胸膜壁层的患者生存率提高,考虑到单纯胸膜侵犯患者接受胸膜外切除和胸壁切除的5年生存率无显著差异[20],如果可以进行胸膜外剥离,主张单独进行胸膜切除术[10,12,20]。胸膜壁层的存在可作为肿瘤浸润的屏障;因此,使用胸膜外剥离术可以在不危及肿瘤手术安全性的前提下限制切除范围[36]。然而,肿瘤浸润的深度和胸壁是否存在分离平面常常取决于术者的判断,术中的病理评估很少起作用:因此胸膜外剥离可能导致更多的不完全切除[12]。如果能够从下方骨骼肌平面成功地剥离胸膜,则可以安全地对侵袭局限于胸膜壁层的特定患者进行胸膜外剥离。如证实扩张超过胸膜壁层,则需要肺和胸壁全切。
最后,年龄>60岁[6,14]和男性[15]作为预后因素也有被报道;然而,这些研究中由于人群较少,不能排除其他变量的混杂效应。
结论
总之,肺癌侵犯胸壁仍然是医疗和手术团队的一个挑战;影响生存率的主要预后因素是淋巴结的状况、病灶浸润的深度、切除范围的扩大和切除的完整性。尽管包括化疗和放疗方案的肺癌侵犯胸壁的多模式治疗仍有争议,但结合手术、新辅助和辅助放疗和化疗的多学科方法是在最佳时间为患者提供最佳解决方案的关键。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Francesco Puma and Hon Chi Suen) for the Focused Issue “Surgical Management of Chest Wall Tumors” published in Current Challenges in Thoracic Surgery. The article was sent for external peer review organized by the Guest Editors and the editorial office.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/ccts.2019.12.01). The Focused Issue “Surgical Management of Chest Wall Tumors” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Deslauriers J, Tronc F, Fortin D. Management of tumors involving the chest wall including pancoast tumors and tumors invading the spine. Thorac Surg Clin 2013;23:313-25. [Crossref] [PubMed]
- Edge SB, Byrd DR, Compton CC, et al. Lung. In: Edge SB, Byrd DR, Compton CC, et al. editors. AJCC cancer staging handbook. From the AJCC cancer staging manual. 7th edition. Chicago: Springer, 2010:299-323.
- Stoelben E, Ludwig C. Chest wall resection for lung cancer: indications and techniques. Eur J Cardiothorac Surg 2009;35:450-6. [Crossref] [PubMed]
- Facciolo F, Cardillo G, Lopergolo M, et al. Chest wall invasion in non-small cell lung carcinoma: a rationale for en bloc resection. J Thorac Cardiovasc Surg 2001;121:649-56. [Crossref] [PubMed]
- Filosso PL, Sandri A, Guerrera F, et al. Primary lung tumors invading the chest wall. J Thorac Dis 2016;8:S855-62. [Crossref] [PubMed]
- Piehler JM, Pairolero PC, Weiland LH, et al. Bronchogenic carcinoma with chest wall invasion: factors affecting survival following en bloc resection. Ann Thorac Surg 1982;34:684-91. [Crossref] [PubMed]
- Allen MS, Mathisen DJ, Grillo HC, et al. Bronchogenic carcinoma with chest wall invasion. Ann Thorac Surg 1991;51:948-51. [Crossref] [PubMed]
- Pitz CC, Brutel de la Rivière A, Elbers HR, et al. Surgical treatment of 125 patients with non-small cell lung cancer and chest wall involvement. Thorax 1996;51:846-50. [Crossref] [PubMed]
- De Pas T, Raimondi S, Pelosi G, et al. A critical appraisal of the adjuvant chemotherapy guidelines for patients with completely resected T3N0 non-small-cell lung cancer. Acta Oncol 2010;49:480-4. [Crossref] [PubMed]
- McCaughan BC, Martini N, Bains MS, et al. Chest wall invasion in carcinoma of the lung. Therapeutic and prognostic implications. J Thorac Cardiovasc Surg 1985;89:836-41. [Crossref] [PubMed]
- Ricci C, Rendina EA, Venuta F. En bloc resection for T3 bronchogenic carcinoma with chest wall invasion. Eur J Cardiothorac Surg 1987;1:23-8. [Crossref] [PubMed]
- Downey RJ, Martini N, Rusch VW, et al. Extent of chest wall invasion and survival in patients with lung cancer. Ann Thorac Surg 1999;68:188-93. [Crossref] [PubMed]
- Chapelier A, Fadel E, Macchiarini P, et al. Factors affecting long-term survival after en-bloc resection of lung cancer invading the chest wall. Eur J Cardiothorac Surg 2000;18:513-8. [Crossref] [PubMed]
- Magdeleinat P, Alifano M, Benbrahem C, et al. Surgical treatment of lung cancer invading the chest wall: results and prognostic factors. Ann Thorac Surg 2001;71:1094-9. [Crossref] [PubMed]
- Burkhart HM, Allen MS, Nichols FC 3rd, et al. Results of en bloc resection for bronchogenic carcinoma with chest wall invasion. J Thorac Cardiovasc Surg 2002;123:670-5. [Crossref] [PubMed]
- Matsuoka H, Nishio W, Okada M, et al. Resection of chest wall invasion in patients with non-small cell lung cancer. Eur J Cardiothorac Surg 2004;26:1200-4. [Crossref] [PubMed]
- Doddoli C, D'Journo B, Le Pimpec-Barthes F, et al. Lung cancer invading the chest wall: a plea for en-bloc resection but the need for new treatment strategies. Ann Thorac Surg 2005;80:2032-40. [Crossref] [PubMed]
- Lin YT, Hsu PK, Hsu HS, et al. En bloc resection for lung cancer with chest wall invasion. J Chin Med Assoc 2006;69:157-61. [Crossref] [PubMed]
- Voltolini L, Rapicetta C, Luzzi L, et al. Lung cancer with chest wall involvement: predictive factors of long-term survival after surgical resection. Lung Cancer 2006;52:359-64. [Crossref] [PubMed]
- Lee CY, Byun CS, Lee JG, et al. The prognostic factors of resected non-small cell lung cancer with chest wall invasion. World J Surg Oncol 2012;10:9. [Crossref] [PubMed]
- Lanuti M. Surgical Management of Lung Cancer Involving the Chest Wall. Thorac Surg Clin 2017;27:195-9. [Crossref] [PubMed]
- Chiappetta M, Nachira D, Congedo M, et al. Non-Small Cell Lung Cancer with Chest Wall Involvement: Integrated Treatment or Surgery Alone? Thorac Cardiovasc Surg 2019;67:299-305. [Crossref] [PubMed]
- Coleman FP. Primary Carcinoma of the Lung, with Invasion of the Ribs: Pneumonectomy and Simultaneous Block Resection of the Chest Wall. Ann Surg 1947;126:156-68. [Crossref] [PubMed]
- Tahiri M, Khereba M, Thiffault V, et al. Preoperative assessment of chest wall invasion in non-small cell lung cancer using surgeon-performed ultrasound. Ann Thorac Surg 2014;98:984-9. [Crossref] [PubMed]
- Padovani B, Mouroux J, Seksik L, et al. Chest wall invasion by bronchogenic carcinoma: evaluation with MR imaging. Radiology 1993;187:33-8. [Crossref] [PubMed]
- Burnard RJ, Martini N, Beattie EJ Jr. The value of resection in tumors involving the chest wall. J Thorac Cardiovasc Surg 1974;68:530-5. [Crossref] [PubMed]
- Mazzella A, Loi M, Mansuet-Lupo A, et al. Clinical Characteristics, Molecular Phenotyping, and Management of Isolated Adrenal Metastases From Lung Cancer. Clin Lung Cancer 2019;20:405-11. [Crossref] [PubMed]
- Loi M, Mazzella A, Mansuet-Lupo A, et al. Synchronous Oligometastatic Lung Cancer Deserves a Dedicated Management. Ann Thorac Surg 2019;107:1053-9. [Crossref] [PubMed]
- Rusch VW, Giroux DJ, Kraut MJ, et al. Induction chemoradiation and surgical resection for superior sulcus non-small-cell lung carcinomas: long-term results of Southwest Oncology Group Trial 9416 (Intergroup Trial 0160). J Clin Oncol 2007;25:313-8. [Crossref] [PubMed]
- Kawaguchi K, Yokoi K, Niwa H, et al. Central Japan Lung Study Group. A prospective, multi-institutional phase II study of induction chemoradiotherapy followed by surgery in patients with non-small cell lung cancer involving the chest wall (CJLSG0801). Lung Cancer 2017;104:79-84. [Crossref] [PubMed]
- Chen D, Wang H, Song X, et al. Preoperative radiation may improve the outcomes of resectable IIIA/N2 non-small-cell lung cancer patients: A propensity score matching-based analysis from surveillance, epidemiology, and end resultsdatabase. Cancer Med 2018;7:4354-60. [Crossref] [PubMed]
- Shah SS, Goldstraw P. Combined pulmonary and thoracic wall resection for stage III lung cancer. Thorax 1995;50:782-4. [Crossref] [PubMed]
- Trastek VF, Pairolero PC, Piehler JM, et al. En bloc (non-chest wall) resection for bronchogenic carcinoma with parietal fixation. Factors affecting survival. J Thorac Cardiovasc Surg 1984;87:352-8. [Crossref] [PubMed]
- Zhao Y, Wang W, Liang H, et al. The Optimal Treatment for Stage IIIA-N2 Non-Small Cell Lung Cancer: A Network Meta-Analysis. Ann Thorac Surg 2019;107:1866-75. [Crossref] [PubMed]
- Yildizeli B, Dartevelle PG, Fadel E, et al. Results of primary surgery with T4 non-small cell lung cancer during a 25-year period in a single center: the benefit is worth the risk. Ann Thorac Surg 2008;86:1065-75; discussion 1074-5. [Crossref] [PubMed]
- Yabuki H, Sakurada A, Eba S, et al. Chest wall/parietal pleural invasions worsen prognosis in T4 non-small cell lung cancer patients after resection. Gen Thorac Cardiovasc Surg 2019;67:788-93. [Crossref] [PubMed]

肖晗
华中科技大学同济医学院附属协和医院。医学博士,华中科技大学同济医学院附属协和医院胸外科博士后,从事肺癌基础研究,参与国家自然科学基金3项、湖北省重点研发基金1项、武汉协和医院院内基金1项,近一年以共同第一作者和通讯作者发表SCI论文2篇。(更新时间:2021/10/17)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Mazzella A, Loi M, Alifano M. Prognostic factors of resected lung cancer with chest wall involvement. Curr Chall Thorac Surg 2020;2:6.



